Mesdames, Messieurs,
Dans un contexte de circulation active du variant Delta et de dégradation de la situation épidémique, il apparaît essentiel d’accroître la couverture vaccinale de tous les publics déjà éligibles en primo-vaccination et en rappel vaccinal, mais aussi d’ouvrir la vaccination à des publics plus jeunes.
L’Agence européenne du médicament a délivré le 25 novembre 2021 une autorisation de mise sur le marché européenne de la forme pédiatrique du vaccin Pfizer-BioNTech. La Haute Autorité de santé (HAS), dans son avis du 25 novembre 2021, et le Comité d’orientation de la stratégie vaccinale (COSV), dans son avis du 6 décembre 2021, recommandent de débuter au plus vite la vaccination des enfants de 5 à 11 ans à risque de forme grave de Covid-19 et de décès ainsi que ceux vivant dans l’entourage d’une personne immunodéprimée.
I/ Périmètre de cette première campagne de vaccination des enfants de 5 à 11 ans
La campagne de vaccination des enfants de 5 à 11 ans concerne à ce stade les enfants présentant au moins une comorbidité ainsi que les enfants vivant dans l’entourage d’une personne immunodéprimée, au sein même du foyer. La liste des comorbidités concernées est celle établie par la HAS, puis complétée par le COSV. Elle figure en annexe.
A ces pathologies peuvent s’ajouter des situations où, au cas par cas, les médecins spécialistes d’organes et de maladies rares peuvent proposer la vaccination à des enfants du fait d’une vulnérabilité conférant un risque majeur de formes graves de Covid-19.
Lors de l’entretien médical pré-vaccinal sur le lieu de vaccination, le médecin vérifiera l’éligibilité de l’enfant au regard des critères énoncés ci-dessus. Cette consultation doit être systématique et se dérouler selon la procédure adaptée à l’âge de l’enfant.
Sont exclus les enfants présentant une contre-indication médicalement reconnue dont la liste figure à l’annexe 2 du décret du 7 août 2021, modifié par le décret n° 2021-1521 du 25 novembre 2021, qui précise les cas de contre-indications. Certaines sont spécifiques aux enfants comme le « syndrome inflammatoire multi systémique pédiatrique » (PIMS).
II/ Offre de vaccination pour les enfants à risques
La vaccination des enfants des 5 à 11 ans les plus à risque doit débuter dès le 15 décembre dans les établissements de santé et services spécialisés (CHU, CH, hôpitaux pédiatriques, établissements spécialisés, centres d’accueil moyens et longs séjours, ESMS accompagnant des enfants en situation de handicap, etc.). Les doses seront livrées dans les PUI les 14 et 16 décembre en fin de journée. Une organisation spécifique sera mise en place au sein de ces structures pour permettre la vaccination des enfants à risque sans délai.
Les enfants suivis dans ces établissements et services ne représentent qu’une partie des enfants prioritaires. Afin de vacciner les autres enfants prioritaires (par exemple les enfants atteints d’obésité), une offre de vaccination en centre de vaccination sera proposée. Des lignes pédiatriques dédiées seront mises en place dès le 15 décembre dans les centres de vaccination identifiés par les ARS.
Pour les enfants de 5 à 11 ans à risque de forme grave, le schéma de vaccination complet est de 2 doses de vaccins à 3 semaines d’intervalle. La forme pédiatrique du vaccin Pfizer-BioNTech est trois fois moins dosée que la forme adulte du vaccin. Une fiche pratique sur l’utilisation de la forme pédiatrique du vaccin Pfizer-BioNTech est disponible en annexe et en ligne sur le site du ministère de la santé.
Il est recommandé de réaliser un test rapide d’orientation diagnostique (TROD) sérologique en amont de chaque vaccination. En fonction du résultat du test, un schéma à une ou deux doses sera proposé. Un risque de réaction sérologique croisée entre les IgG SARS-CoV-2 et celles ciblant le virus de la dengue a été décrite. Ce risque de faux positifs conduit à ne pas recommander l’utilisation des TROD dans les zones où la dengue est présente, c’est-à-dire dans tous les départements et régions d’outre-mer (excepté Saint-Pierre-et-Miquelon).
La deuxième dose doit intervenir 3 semaines après la première, sauf dans les deux exceptions suivantes :
– Les enfants ayant déjà contracté le Covid-19 ne doivent recevoir qu’une seule dose ;
– Les enfants ayant contracté le Covid-19 plus de 15 jours après la première dose de vaccin ne doivent recevoir qu’une seule dose. Il peut être alors considéré que l’infection représente une stimulation équivalente à l’injection d’une seconde dose de vaccin.
Les enfants ayant contracté le Covid-19 moins de 15 jours après la première dose de vaccin doivent recevoir une seconde dose deux mois après l’infection.
Les TROD sérologiques ne sont pas indiqués pour les enfants sévèrement immunodéprimés qui devront recevoir deux doses de vaccin. Sur avis médical, ces enfants peuvent recevoir jusqu’à trois injections de vaccin – ou au moins deux injections de vaccin en cas d’infection antérieure à la Covid-19.
La présence d’au moins un parent accompagnateur est nécessaire à la vaccination de cette classe d’âge. Un formulaire d’autorisation parentale signé par au moins l’un des deux parents doit également être remis au personnel du lieu de vaccination avant de procéder à la vaccination de l’enfant. Ce formulaire est le même que celui utilisé dans le cadre de la vaccination des adolescents de 12 à 15 ans (disponible ici). Ce formulaire doit être conservé selon les mêmes modalités que le formulaire d’autorisation parentale pour les adolescents de 12 à 15 ans.
La vaccination sera ouverte dans ces centres dès le 15 décembre pour ceux rattachés à une PUI livrée le 14 décembre, et dès le 17 décembre pour ceux rattachés à une PUI livrée le 16 décembre.
En complément de cette offre en établissement et en centre de vaccination, la vaccination peut être réalisée en cabinet de ville par les professionnels de santé libéraux (médecins et IDE sur prescription médicale) qui souhaitent vacciner leur patientèle pédiatrique éligible, y compris à domicile. Les professionnels peuvent se procurer des doses pédiatriques dans les centres de vaccination proposant la vaccination pédiatrique. Cette mise à disposition de flacons et de dispositifs associés est coordonnée par chaque ARS.
Depuis le 13 décembre, les médecins peuvent commander des doses pédiatriques Pfizer-BioNTech (1 flacon) sur le portail des commandes en vue d’une livraison entre le 24 et le 28 décembre. A la livraison de ces doses, ces professionnels pourront vacciner les enfants éligibles.
III/ Approvisionnements en doses pédiatriques
Les livraisons de la formulation Comirnaty pédiatrique s’effectueront directement par le laboratoire Pfizer dans les PUI des établissements pivots et sur deux plateformes prestataires de Santé publique France. Un premier approvisionnement de 1,9 million de doses sera livré en décembre, dont environ 900 000 doses à destination immédiate des PUI, puis un million de doses supplémentaires en janvier. Environ la moitié des PUI des établissements pivots sera livrée le mardi 14 décembre, et l’autre le jeudi 16 décembre.
Ces doses permettront d’approvisionner les établissements de santé et les établissements spécialisés assurant le suivi des enfants fragiles afin qu’ils puissent commencer la vaccination des enfants de 5 à 11 ans les plus à risque de forme grave sans attendre. Elles auront également vocation à approvisionner les centres de vaccination.
IV/ Modalités d’extension éventuelle de la vaccination pédiatrique à tous les enfants de 5 à 11 ans
Des avis complémentaires de la HAS, du Conseil consultatif national d’éthique (CCNE) et du COSV concernant l’ouverture et les modalités de la campagne de vaccination à l’ensemble des enfants de 5 à 11 ans sont attendus dans les prochains jours. Dans le cas d’une extension de la vaccination à tous les enfants de 5 à 11 ans, il est demandé à l’ensemble des professionnels de s’y préparer afin qu’elle puisse être mise en œuvre dans les délais les plus brefs.
Cette vaccination sera possible à la fois en centre de vaccination et dans les cabinets médicaux.
A partir du 20 décembre, chaque centre de vaccination devra être en mesure d’ouvrir au moins une ligne de vaccination pédiatrique, à l’exception des centres présentant des difficultés organisationnelles manifestes.
En fonction des décisions des autorités scientifiques, des informations supplémentaires vous seront communiquées.
Bernard CELLI Pr. Jérôme SALOMON
Responsable de la Task Force Vaccination Directeur général de la Santé
Annexe 1 : Liste des pathologies prioritaires
La liste des pathologies prioritaires telle que définie par la HAS et complété par le COSV est la suivante :
– Cardiopathies congénitales non corrigées
– Asthmes pour lesquels il existe une nécessité de recours aux corticoïdes par voie générale, ou ayant nécessité une hospitalisation ou ALD
– Maladies hépatiques chroniques
– Maladies cardiaques et respiratoires chroniques
– Cancer en cours de traitement
– Maladie rénale chronique
– Handicap neuromusculaire sévère
– Maladies neurologiques
– Immunodéficience primitive ou secondaire (infection par le VIH ou induite par médicaments)
– Obésité
– Diabète
– Hémopathies malignes
– Drépanocytose
– Trisomie 21
Annexe 2 : fiche pratique du vaccin Comirnaty « pediatrique »

Une autorisation de mise sur le marché (AMM) a été délivrée au vaccin pédiatrique Comirnaty 10 microgrammes/dose, dispersion à diluer pour solution injectable à destination des enfants âgés de 5 à 11 ans. Les conditions d’utilisation du vaccin sont reprises ci-dessous :
VERIFICATION DES FLACONS DE COMIRNATY PEDIATRIQUE
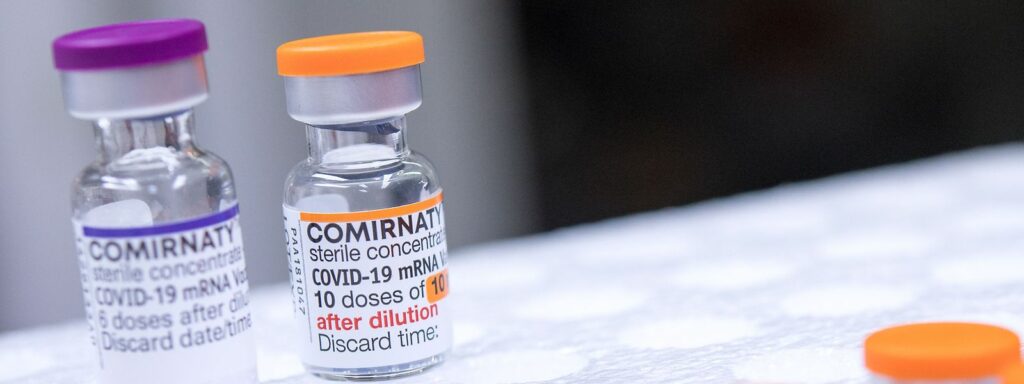
- Vérifier que le flacon est bien muni d’un couvercle en plastique orange, propre au vaccin Comirnaty pédiatrique.
MANIPULATION AVANT UTILISATION DE COMIRNATY PEDIATRIQUE
- Si le flacon multidose est conservé congelé, il doit être décongelé avant utilisation. Pour la décongélation, les flacons congelés doivent être placés à une température de 2°C à 8°C. Pour une boîte de 10 flacons, la décongélation pourra prendre 4 heures. Les flacons congelés peuvent également être décongelés individuellement à une température allant jusqu’à 30°C pendant 30 minutes.
- Veiller à ce que les flacons soient totalement décongelés avant utilisation.
- Les flacons non ouverts peuvent être conservés pendant un maximum de 10 semaines entre 2°C et 8°C, dans la limite des 9 mois de conservation entre -90 °C et -60 °C. Aussi, lorsque les flacons sont placés à une température de 2°C à 8°C pour être conservés, la date limite d’utilisation doit être actualisée sur l’emballage.
- Avant utilisation, le flacon non ouvert peut être conservé pendant un maximum de 12 heures à des températures allant jusqu’à 30°C. Les flacons décongelés peuvent être manipulés dans des conditions d’éclairage intérieur.
MELANGE AVANT DILUTION DE COMIRNATY PEDIATRIQUE
- Laisser le flacon décongelé se réchauffer à température ambiante et le retourner délicatement à 10 reprises avant la dilution. Ne pas secouer.
- Avant la dilution, la dispersion décongelée peut contenir des particules amorphes opaques de couleur blanche à blanc cassé.
DILUTION DE COMIRNATY PEDIATRIQUE
- Le vaccin décongelé doit être dilué dans son flacon d’origine à l’aide de 1,3 mL de solution injectable de chlorure de sodium à 9 mg/mL (0,9 %), en utilisant une aiguille de calibre 21 G (gauge) ou plus fine et en respectant les règles d’asepsie.
- Avant de retirer l’aiguille du bouchon du flacon, équilibrer la pression du flacon en aspirant 1,3 mL d’air dans la seringue de diluant vide.
- Retourner délicatement la solution diluée à 10 reprises. Ne pas secouer.
- Le vaccin dilué doit avoir l’aspect d’une dispersion de couleur blanche à blanc cassé, exempte de particules visibles. Ne pas utiliser le vaccin dilué si la présence de particules ou une coloration anormale sont observées.
Après dilution, le flacon contient 2,6 mL soit 10 doses annoncées de 0,2 mL de vaccin. Toutefois, dans certaines conditions de réalisation et avec du matériel à faible volume mort, il est possible théoriquement d’extraire jusqu’à 12 doses.
- La date et l’heure de l’expiration de la solution diluée doivent être inscrites sur les flacons dilués.
- Après dilution, le produit doit être conservé entre 2°C et 30°C et être utilisé dans les 12 heures.
- Ne pas congeler ni secouer la solution diluée. Si elle est conservée au réfrigérateur, laisser la solution diluée atteindre la température ambiante avant de l’utiliser.
PRÉPARATION DES DOSES INDIVIDUELLES DE 0,2 mL DE COMIRNATY PEDIATRIQUE
- En utilisant une technique aseptique, nettoyer le bouchon du flacon à l’aide d’une compresse à usage unique imprégnée d’antiseptique.
- Prélever 0,2 mL de Comirnaty pédiatrique.
- Des aiguilles et/ou seringues à faible volume mort doivent être utilisées pour pouvoir extraire jusqu’à 12 doses à partir d’un flacon unique. La combinaison de l’aiguille et de la seringue doit avoir un volume mort ne dépassant pas 35 microlitres.
- Par ailleurs, le résumé des caractéristiques du produit indique que si des aiguilles et seringues classiques sont utilisées, le volume risque de ne pas être suffisant pour permettre l’extraction de dix doses d’un flacon unique.
- Chaque dose doit contenir 0,2 mL de vaccin.
- Si la quantité de vaccin restant dans le flacon ne permet pas d’obtenir une dose complète de 0,2 mL, jeter le flacon et la solution résiduelle.
- Éliminer tout vaccin non utilisé dans les 12 heures suivant la dilution.
ATTENTION : Une vigilance particulière devra être portée lors de la préparation du vaccin afin d’éviter toute confusion entre un flacon de vaccin Comirnaty Adulte (couvercle violet) et un flacon de vaccin Comirnaty Pédiatrique (couvercle orange), et afin de prévenir toute erreur d’injection. Une dernière vérification avant l’injection est souhaitable.
Les messages “dgs-urgent” sont émis depuis une boîte à lettres DGS-URGENT@diffusion.dgs-urgent.sante.gouv.fr ou dgs-urgent@dgs.mssante.fr.
Pour vérifier qu’ils ont bien été émis par une personne autorisée du ministère de la santé, consultez la liste des messages disponible sur le site Internet du ministère.
Source : DGS / Mission de l’information et de la communication / Sous-direction Veille et sécurité sanitaire (VSS)


