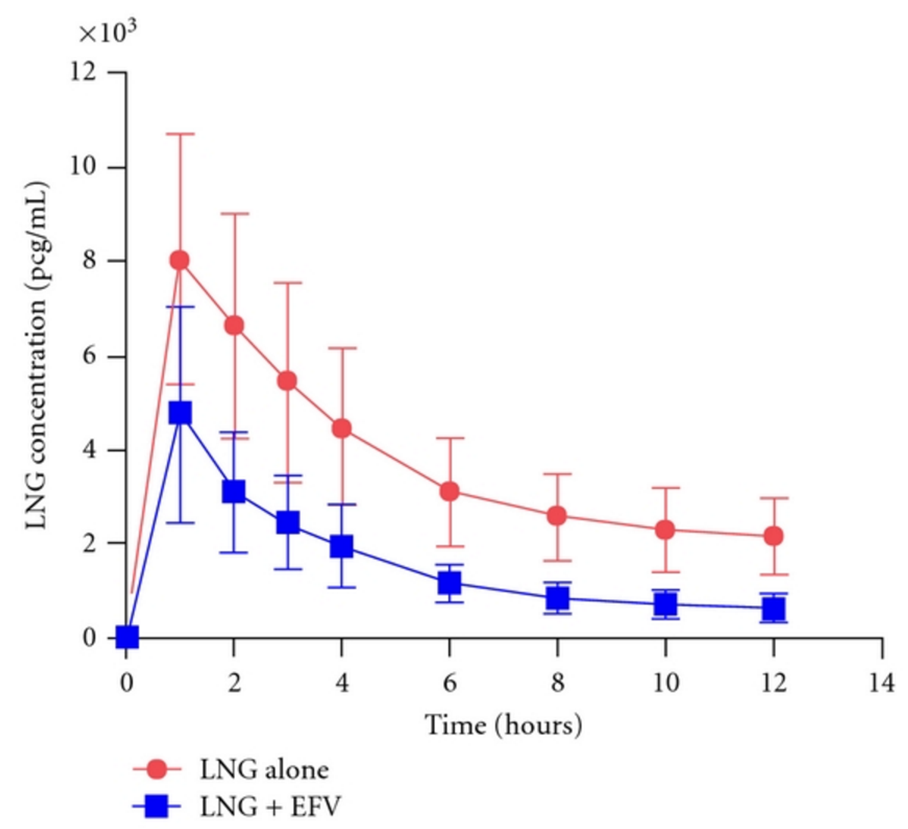
Le J.O du 10 janvier 2017 annonce l’application pour partie de la réglementation des stupéfiants aux médicaments à base de zolpidem (Stilnox et génériques) administrés par voie orale.
La mesure entrera en vigueur dans 90 jours, soit le 10 avril 2017.
A cette date, la prescription devra être rédigée sur une ordonnance sécurisée et indiquer en toutes lettres le nombre d’unités thérapeutiques par prise, le nombre de prises et le dosage du médicament.
La durée de prescription restera limitée à 28 jours.
Le chevauchement de deux ordonnances n’est pas autorisé, sauf mention expresse du prescripteur.
Le délai de présentation de l’ordonnance à l’officine de 3 jours ne s’appliquera pas, ni le fractionnement de la délivrance.
Arrêté du 7 janvier 2017 portant application d’une partie de la réglementation des stupéfiants aux médicaments à base de zolpidem administrés par voie orale
Les médicaments à base de zolpidem administrés par voie orale sont soumis aux dispositions des articles R. 5132-5, R. 5132-29, R. 5132-33 à l’exception du premier alinéa du code de la santé publique.
Article R5132-1
Les dispositions de la présente section s’appliquent aux médicaments mentionnés à l’article L. 5111-1, lorsque ces médicaments :
1° Sont classés, sur proposition du directeur général de l’Agence française de sécurité sanitaire des produits de santé, par arrêté du ministre chargé de la santé, sur les listes I ou II définies à l’article L. 5132-6, ou comme stupéfiants ;
2° Ou renferment une ou plusieurs substances ou préparations classées, sur proposition du directeur général de l’agence par arrêté du ministre chargé de la santé, sur les listes I ou II ou comme stupéfiants.
Lorsque les substances, préparations ou médicaments mentionnés aux 1° et 2° sont utilisés en médecine vétérinaire, le directeur général de l’Agence française de sécurité sanitaire des produits de santé sollicite, préalablement à sa proposition, l’avis du directeur général de l’Agence française de sécurité sanitaire des aliments.
Les médicaments mentionnés aux alinéas précédents peuvent faire l’objet d’un classement autre que celui de la ou des substances ou préparations classées qu’ils comportent. Ils sont alors soumis au régime se rapportant au classement mentionné au 1° ci-dessus.
Lorsqu’un médicament non classé contient plusieurs substances ou préparations relevant d’un classement différent, il est soumis au régime le plus strict se rapportant au classement de ces substances ou préparations selon l’ordre décroissant suivant : stupéfiant, liste I, liste II.
Article R5132-5
La prescription ainsi que toute commande à usage professionnel de médicaments ou produits destinés à la médecine humaine ou de médicaments destinés à la médecine vétérinaire, classés comme stupéfiants ou soumis à la réglementation des stupéfiants est rédigée sur une ordonnance répondant à des spécifications techniques fixées, après avis du directeur général de l’Agence nationale de sécurité du médicament et des produits de santé, par arrêté du ministre chargé de la santé.
Article R5132-29
Il est interdit de prescrire et de délivrer des substances classées comme stupéfiants lorsqu’elles ne sont pas contenues dans une spécialité pharmaceutique ou une préparation.
Outre les mentions prévues aux articles R. 5132-3 et R. 5132-4 ou, pour les médicaments vétérinaires, au I de l’article R. 5141-111, l’auteur d’une ordonnance, comportant une prescription de médicaments classés comme stupéfiants ou soumis à la réglementation des stupéfiants, indique en toutes lettres le nombre d’unités thérapeutiques par prise, le nombre de prises et le dosage s’il s’agit de spécialités, les doses ou les concentrations de substances et le nombre d’unités ou le volume s’il s’agit de préparations.