En réponse aux ruptures d’approvisionnement impactant depuis plusieurs mois les médicaments à base de sertraline, les autorités sanitaires ont décidé de mettre en place un dispositif temporaire visant à prévenir toute interruption de traitement. Conformément à la recommandation de remplacement formulée par l’Agence Nationale de Sécurité du Médicament et des Produits de Santé (ANSM), en cas d’indisponibilité d’une spécialité à base de sertraline vous êtes désormais autorisés à la remplacer par une préparation magistrale de sertraline.
La FSPF n’a cessé d’alerter sur les difficultés d’approvisionnement en sertraline qui persistent depuis plusieurs mois sans qu’aucune réponse n’ait été apportée dans des délais raisonnables. S’agissant de la rémunération, une fois de plus, nous déplorons la fixation de tarifs extrêmement bas. Comme d’habitude, ces montants ont été arrêtés unilatéralement par le ministère de la Santé, sans aucune concertation préalable avec les représentants de la profession. Aux côtés des représentants des préparatoires, nous demandons au ministère de la Santé une réévaluation de la rémunération fixée en contrepartie de notre prestation.
Vous trouverez ci-après les modalités de remplacement et de facturation des préparations magistrales de sertraline.
1) Modalités de mise en œuvre
La recommandation de remplacement de l’ANSM prévoit qu’en cas d’indisponibilité de la spécialité de sertraline initialement prescrite, vous avez la possibilité à titre exceptionnel et temporaire, de délivrer une préparation magistrale de sertraline 25 mg et/ou 50 mg en remplacement du médicament indisponible.
Ce remplacement peut être effectué sans que le patient ne vous présente une nouvelle ordonnance et sous réserve que la préparation magistrale délivrée permette d’administrer la posologie prescrite.
Le remplacement de la spécialité prescrite par une préparation magistrale doit respecter la dose totale journalière prescrite et les modalités de prise déterminées selon le tableau d’équivalence suivant :

Afin de faciliter la mise en œuvre de ce dispositif, l’ANSM mettra prochainement à votre disposition une monographie.
2) Modalités de dispensation des préparations magistrales
Lors de la première dispensation d’une préparation magistrale de sertraline pour un patient, vous devez obligatoirement informer le prescripteur de ce remplacement par tous moyens appropriés.
Lors de la délivrance de ces préparations magistrales, vous êtes tenus de :
- Informer le patient du remplacement effectué et lui expliquer de manière claire les modalités de prise de la préparation magistrale.
- Conseiller au patient de consulter son médecin en cas de survenue d’effets indésirables ou de symptômes jugés inhabituels, ou encore si le patient constate que le traitement n’agit pas comme d’habitude.
- Inscrire sur l’ordonnance la mention suivante : « Préparation magistrale n° (numéro d’ordonnancier) à base de sertraline en remplacement de la spécialité à base de sertraline prescrite, selon la recommandation de l’ANSM », ainsi que la posologie correspondante.
- Remettre au patient les fiches d’utilisation, disponibles sur le site de l’ANSM.
3) Tarification et facturation
Un arrêté publié au Journal officiel du 14 mai 2025 fixe les tarifs de ces préparations, tarifs applicables à compter du 15 mai.
Les préparations magistrales à base de sertraline seront facturées à l’Assurance maladie au moyen d’un code acte « PMR » et seront remboursées à hauteur de 65 %.
Le prix de vente au public de ces préparations magistrales est fixé dans les conditions suivantes :
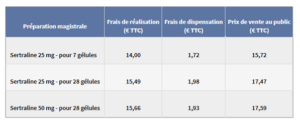
Lors de la dispensation, il convient de veiller à dispenser le conditionnement de la préparation le plus économique compatible avec la délivrance pour un mois.






