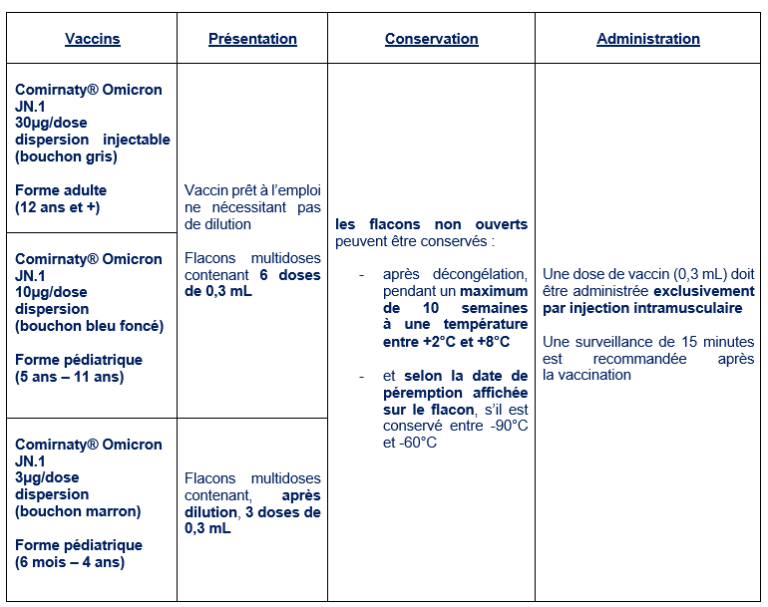
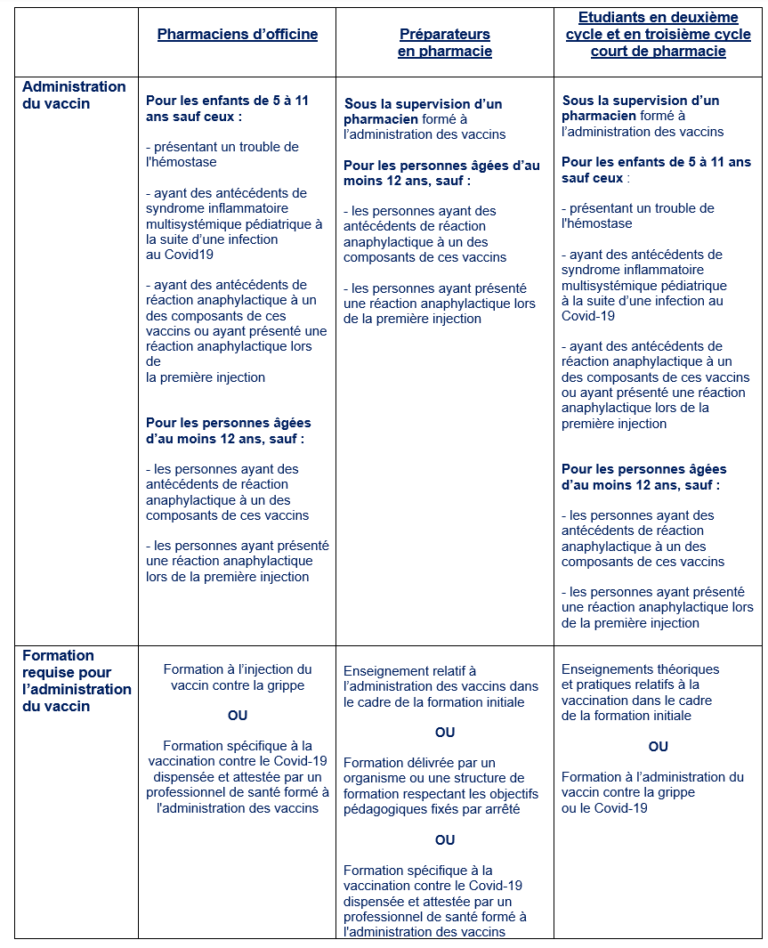
Madame, monsieur, le(s) pharmacien(s) titulaire(s),
La campagne annuelle de télédéclaration du chiffre d’affaires annuel est ouverte à partir du 7 avril 2025 et doit se terminer au plus tard le 30 juin 2025.
A cet effet, vous êtes invités à vous connecter à la plateforme officielle sécurisée (en utilisant Mozilla ou Firefox), pour procéder à cette déclaration réglementaire via l’url suivante :
https://declarations-pharmacie.ars.sante.fr
Vous vous identifierez au moyen de votre carte de professionnel de santé (CPS ou e-CPS) et à défaut, il vous sera proposé d’utiliser une connexion alternative permettant votre identification, ainsi que celle de votre pharmacie.
Pour le(s) pharmacien(s) titulaire(s) ayant cédé(s) leur officine avant le 7 avril 2025, il relève de la responsabilité du pharmacien actuellement titulaire d’effectuer cette déclaration.
Pour la période du 1er janvier 2024 au 31 décembre 2024, il vous sera demandé de renseigner les informations suivantes :
– le chiffre d’affaires lié aux ventes de médicaments et produits relevant des taux de TVA 0%, 5%, 10% et 20%,
– le chiffre d’affaires lié aux ventes de médicaments relevant du taux de TVA 2,1% (à l’exclusion de la part du prix du médicament supérieur à « 1930 € » PFHT). Un médicament dont le prix unitaire est de 30 000 € n’entre en compte dans l’activité de l’officine qu’à hauteur de 1930 €, qui est la part du prix du médicament au-delà de laquelle la marge du pharmacien est nulle,
– le montant des honoraires et rémunérations perçus pour les missions réalisées au cours de l’année 2024 (hors vaccinations et TROD effectués dans le cadre de la lutte contre la Covid-19, ROSP, indemnités forfaitaires d’astreintes),
– la durée hebdomadaire (en heures) d’exercice de votre(vos) adjoint(s) présents dans votre officine à ce jour,
– l’effectif (en ETP) de préparateurs en pharmacie,
– l’effectif (en ETP) des autres personnels.
Pour votre information, les éléments suivants ne sont pas à déclarer dans l’activité de l’officine :
– les vaccinations et TROD effectués dans le cadre de la lutte contre la Covid-19 : instaurés par des dispositions dérogatoires issues des différents textes liés à l’état d’urgence sanitaire ou de gestion de la sortie de crise sanitaire, ces actes répondent à une demande liée à une situation sanitaire exceptionnelle et n’entrent pas à ce jour dans la liste des actes que les pharmaciens d’officine sont autorisés à pratiquer de manière pérenne,
– de même les ROSP (pour développer le bon usage des produits de santé ou « ROSP BUPS ») et les indemnités forfaitaires d’astreintes.
Les rémunérations et honoraires perçus pour la réalisation de ces actes ne devront pas être compris dans la déclaration d’activité.
Si vous rencontrez des difficultés, ou si vous souhaitez obtenir des précisions sur cette télédéclaration, vous pouvez solliciter vos interlocuteurs habituels de l’ARS sur ce sujet, ou bien les interroger à l’aide du formulaire de « demande de support » disponible à toutes les étapes de la déclaration.
Avant de valider votre déclaration, n’oubliez pas de télécharger votre preuve de dépôt. Aucun justificatif de déclaration ne pourra vous être adressé ultérieurement.
Pour votre information, il est rappelé que :
Conformément à l’article R.5125-37 du code de la santé publique, « Le pharmacien titulaire d’une officine ou gérant après décès ou le pharmacien gérant d’une pharmacie mutualiste ou d’une société de secours minière est tenu, chaque année, au plus tard à une date fixée par arrêté du ministre chargé de la santé, de déclarer au directeur général de l’agence régionale de santé le nombre et le nom des pharmaciens exerçant dans l’officine ainsi que la mesure de l’activité globale, au sens de l’article R.5125-37-1, de celle-ci sur l’année civile précédente. ».
Cette activité est appréciée au regard des dispositions de l’article R.5125-37-2 du code de la santé publique qui précise que : « L’arrêté mentionné au dernier alinéa de l’article L.5125-15 fixe le nombre requis de pharmaciens adjoints, en fonction de l’importance de l’activité globale de l’officine sur l’année précédente, en équivalents temps plein. ».
De plus, le décret n°2021-1720 du 20 décembre 2021relatif aux conditions d’appréciation de l’activité des officines de pharmacie, pris en application de l’article L.5125-15 du code de la santé publique issu de la loi ASAP du 7 décembre 2020, met en œuvre la réforme de l’assiette de référence servant de base à la détermination du nombre de pharmaciens adjoints dans les officines et définit les nouvelles modalités de la déclaration de l’activité globale d’une officine.
Enfin, l’article R.5125-37-1 du code de la santé publique précise que : « L’activité globale de l’officine, mentionnée à l’article L.5125-15 et prise en compte pour la détermination du nombre requis de pharmaciens adjoints, est appréciée en cumulant :
«1° Le chiffre d’affaires total hors taxes issu de la vente de médicaments, produits et autres marchandises, quelle qu’en soit la nature, à l’exception de celui correspondant à la part du prix des médicaments remboursables sur laquelle la marge du pharmacien d’officine fixée par voie règlementaire est nulle ;
«2° Les rémunérations et honoraires mentionnés au 6° (permanence pharmaceutique) de l’article L.162-16-1 du code de la sécurité sociale, à l’exclusion de l’indemnité forfaitaire d’astreinte, et aux 7° (honoraires de dispensation) 7° bis (bilans de médication ou d’entretiens d’accompagnement ou de suivi de patients atteints d’une pathologie chronique), 13° (participation à un cadre d’exercice coordonné), 14° (vaccinations ), 15° (activités de télésoin) et 16° (tests de diagnostic rapide) du même article;
«3° Les rémunérations et honoraires, autres que ceux mentionnés à l’article L. 162-16-1 précité, perçus dans le cadre des missions prévues à l’article L.5125-1-1 A du présent code. ».
Je vous prie d’agréer, madame, monsieur, le(s) pharmacien(s) titulaire(s), l’expression de mes salutations distinguées.
| Hervé FROMENT Gestionnaire administratif des activités pharmaceutiques et biologiques Département Pharmacie et Biologie Direction de l’Organisation des soins Téléphone bureau : 04 13 55 80 83 www.paca.ars.sante.fr |